Bravecto® Spot-on Hund

Antiparasitikum (Fluralaner)
Zusammensetzung
Jeder ml enthält 280 mg Fluralaner.
Eine Pipette ergibt:
| Pipetteninhalt (ml) | Fluralaner (mg) | |
| für sehr kleine Hunde 2 – 4,5 kg | 0,4 | 112,5 |
| für kleine Hunde >4,5 – 10 kg | 0,89 | 250 |
| für mittelgroße Hunde >10 – 20 kg | 1,79 | 500 |
| für große Hunde >20 – 40 kg | 3,57 | 1 000 |
| für sehr große Hunde >40 – 56 kg | 5,0 | 1 400 |
Klare farblose bis gelbe Lösung.
Zieltierart(en)
Hund
Anwendungsgebiet(e)
Zur Behandlung eines Zecken- und Flohbefalls bei Hunden.
Dieses Tierarzneimittel ist ein systemisches Insektizid und Akarizid und bietet eine
- sofortige und anhaltende abtötende Wirkung gegen Flöhe (Ctenocephalides felisund Ctenocephalides canis) über 12 Wochen, und
- sofortige und anhaltende Zecken-abtötende Wirkung (Ixodes ricinus, Rhipicephalus sanguineus und Dermacentor reticulatus)über 12 Wochen.
Flöhe und Zecken müssen am Wirt anheften und mit der Nahrungsaufnahme beginnen, um dem Wirkstoff ausgesetzt zu werden.
Das Tierarzneimittel kann als Teil der Behandlungsstrategie gegen die allergische Flohdermatitis (FAD) eingesetzt werden.
Zur Behandlung der durch Demodex canis verursachten Demodikose.
Zur Behandlung eines Sarcoptes-Räude (Sarcoptes scabiei var. canis) Befalls.
Gegenanzeigen
Nicht anwenden bei bekannter Überempfindlichkeit gegenüber dem Wirkstoff oder einem der sonstigen Bestandteile.
Besondere Warnhinweise
Besondere Warnhinweise für jede Zieltierart:
Parasiten müssen mit der Nahrungsaufnahme auf dem Wirt beginnen, um gegen Fluralaner exponiert zu werden. Deshalb kann ein Risiko der Übertragung von Krankheiten durch Parasiten nicht ausgeschlossen werden.
Eine unnötige oder von den Vorgaben in der Fachinformation abweichende Anwendung von Antiparasitika kann den Resistenzselektionsdruck erhöhen und zu einer verminderten Wirksamkeit führen. Die Entscheidung über die Anwendung des Tierarzneimittels sollte auf dem Nachweis der Parasitenspezies und der Befallsstärke bzw. des Infektionsrisikos, welches auf den epidemiologischen Besonderheiten jedes Einzeltieres basiert, beruhen.
Die Möglichkeit, dass andere im gleichen Haushalt lebende Tiere eine Quelle für eine Reinfektion mit Parasiten sein können, sollte bedacht werden. Diese Tiere sollten, sofern erforderlich mit einem geeigneten Tierarzneimittel behandelt werden.
Besondere Vorsichtsmaßnahmen für die Anwendung bei Tieren:
Es ist darauf zu achten, dass es nicht zu einem Kontakt mit den Augen des Tieres kommt.
Nicht direkt auf Hautverletzungen auftragen.
Hunde in den ersten 3 Tagen nach der Behandlung nicht waschen oder in Wasser eintauchen und nicht in Gewässern schwimmen lassen.
Dieses Tierarzneimittel sollte nicht bei Welpen im Alter von weniger als 8 Wochen und bei Hunden mit einem Gewicht unter 2 kg angewendet werden, da entsprechende Daten nicht vorliegen.
Das Tierarzneimittel sollte nicht in Abständen unter 8 Wochen angewendet werden, da die Verträglichkeit bei kürzeren Intervallen nicht geprüft wurde.
Dieses Tierarzneimittel ist zum Auftropfen auf die Haut und darf nicht oral verabreicht werden.
Besondere Vorsichtsmaßnahmen für den Anwender:
Kontakt mit dem Tierarzneimittel sollte vermieden werden und die am Abgabeort erhaltenen Einweg-Schutzhandschuhe müssen beim Umgang mit dem Tierarzneimittel aus folgenden Gründen getragen werden:
Überempfindlichkeitsreaktionen, die möglicherweise schwerwiegend sein können, wurden bei einer geringen Anzahl von Personen berichtet.
Personen mit einer Überempfindlichkeit gegenüber Fluralaner oder einem der sonstigen Bestandteile sollten jegliche Exposition gegenüber dem Tierarzneimittel vermeiden.
Das Tierarzneimittel bindet an die Haut und kann nach versehentlichem Verschütten auch an Oberflächen binden. Hautausschläge, Kribbeln oder Taubheitsgefühle wurden bei einer geringen Anzahl von Personen nach Hautkontakt berichtet.
Bei Hautkontakt die betroffene Stelle sofort mit Seife und Wasser waschen. In manchen Fällen reichen Seife und Wasser nicht aus, um ausgelaufenes Tierarzneimittel von den Fingern zu entfernen. Ein Kontakt mit dem Tierarzneimittel kann auch beim Umgang mit dem behandelten Tier zustande kommen.
Vergewissern Sie sich, dass die Applikationsstelle bei Ihrem Tier nicht mehr erkennbar ist, bevor Sie diese wieder berühren. Dies bezieht sich auch auf das Kuscheln oder den Aufenthalt im gleichen Bett mit dem Tier. Es dauert bis zu 48 Stunden, bis die Applikationsstelle trocken wird, aber sie wird länger erkennbar sein.
Sollten Hautreaktionen auftreten, ziehen Sie einen Arzt zu Rate und zeigen Sie ihm die Verpackung des Tierarzneimittels.
Personen mit einer empfindlichen Haut oder bekannter allgemeiner Allergie, z. B. gegen andere Tierarzneimittel aus dieser Klasse, sollten dieses Tierarzneimittel und die damit behandelten Tiere mit Vorsicht behandeln.
Dieses Tierarzneimittel kann Augenreizungen verursachen. Im Falle eines Augenkontaktes sofort reichlich mit Wasser spülen.
Das Tierarzneimittel ist bei oraler Aufnahme schädlich. Bewahren Sie das Tierarzneimittel bis zur Anwendung in der Originalverpackung auf, um Kindern den direkten Zugriff zu verwehren. Eine gebrauchte Pipette sollte sofort entsorgt werden. Bei versehentlicher Einnahme ist unverzüglich ein Arzt zu Rate zu ziehen und die Packungsbeilage oder das Etikett vorzuzeigen.
Das Tierarzneimittel ist leicht entflammbar. Von Hitze, Funken, offenem Feuer oder anderen Zündquellen fernhalten.
Versehentliche Spritzer, beispielsweise auf einen Tisch oder den Fußboden, mit einem Papiertuch entfernen und die Fläche mit einem Reinigungsmittel säubern.
Besondere Vorsichtsmaßnahmen für den Umweltschutz:
Behandelte Hunde sollten 48 Stunden nach der Behandlung nicht in Oberflächengewässer gehen, um schädliche Auswirkungen auf Wasserorganismen zu vermeiden.
Trächtigkeit, Laktation, Fortpflanzungsfähigkeit:
Kann bei Zuchttieren sowie trächtigen und laktierenden Hunden angewendet werden.
Wechselwirkungen mit anderen Arzneimitteln und andere Wechselwirkungen:
Keine bekannt.
Fluralaner wird in hohem Masse an Plasmaproteine gebunden und kann mit anderen stark bindenden Wirkstoffen, wie nicht-steroidalen Entzündungshemmern (NSAIDs) oder dem Cumarin-Derivat Warfarin, konkurrieren. Die Zugabe von Fluralaner in Hundeplasma bei Anwesenheit von Carprofen oder Warfarin bei den maximal anzunehmenden Plasmakonzentrationen beeinflusste die Proteinbindung von Fluralaner, Carprofen oder Warfarin nicht.
Während der Laborstudien und der klinischen Feldstudien wurden keine Wechselwirkungen zwischen diesem Tierarzneimittel und routinemäßig verabreichten Tierarzneimitteln beobachtet.
Überdosierung (Symptome, Notfallmaßnahmen, Gegenmittel):
Die Verträglichkeit wurde bei 8 – 9 Wochen alten Welpen mit Körpergewichten von 2,0 – 3,7 kg, die mit Überdosierungen bis zum 5-Fachen der maximal empfohlenen Dosis zu 3 Zeitpunkten in kürzeren Abständen als empfohlen (8-Wochen-Intervalle) behandelt wurden, belegt.
Die Verträglichkeit wurde bei Zuchttieren sowie trächtigen und laktierenden Tieren, die mit Überdosierungen bis zum 3-Fachen der maximal empfohlenen Dosis behandelt wurden, belegt.
Dieses Tierarzneimittel wurde von Collies mit defektem Multidrug-Resistance-Protein 1 (MDR1 -/-) nach einmaliger oraler Gabe des 3-Fachen der maximal empfohlenen Dosis gut vertragen.
Inkompatibilitäten:
Keine bekannt.
Nebenwirkungen
Hund:
| Häufig (1 bis 10 Tiere / 100 behandelte Tiere): | Hautreaktionen an der Applikationsstelle (wie Rötung, Haarausfall)# |
| Sehr selten (< 1 Tier/10 000 behandelte Tiere, einschließlich Einzelfallberichte): | Lethargie, Anorexie Erbrechen, Muskelzittern, Ataxie, Krämpfe |
# mild und vorübergehend
Die Meldung von Nebenwirkungen ist wichtig. Sie ermöglicht die kontinuierliche Überwachung der Verträglichkeit eines Tierarzneimittels. Falls Sie Nebenwirkungen, insbesondere solche, die nicht in der Packungsbeilage aufgeführt sind, bei Ihrem Tier feststellen, oder falls Sie vermuten, dass das Tierarzneimittel nicht gewirkt hat, teilen Sie dies bitte zuerst Ihrem Tierarzt mit. Sie können Nebenwirkungen auch an den Zulassungsinhaber unter Verwendung der Kontaktdaten am Ende dieser Packungsbeilage oder über Ihr nationales Meldesystem melden.
Dosierung für jede Tierart, Art und Dauer der Anwendung
Zum Auftropfen auf die Haut.
Bravecto sollte nach der folgenden Tabelle verabreicht werden (entsprechend einer Dosis von 25 – 56 mg Fluralaner/kg Körpergewicht):
| Körpergewicht des Hundes (kg) | Stärke und Anzahl der anzuwendenden Pipetten | ||||
| Bravecto 112,5 mg | Bravecto 250 mg | Bravecto 500 mg | Bravecto 1 000 mg | Bravecto 1 400 mg | |
| 2 – 4,5 | 1 | ||||
| >4,5 – 10 | 1 | ||||
| >10 – 20 | 1 | ||||
| >20 – 40 | 1 | ||||
| >40 – 56 | 1 | ||||
Für Hunde mit mehr als 56 kg Körpergewicht die Kombination von zwei Pipetten verwenden, die das Körpergewicht am besten abdeckt.
Unterdosierung kann zu einer unwirksamen Anwendung führen und kann eine Resistenzentwicklung begünstigen.
Hinweise für die richtige Anwendung
Art der Anwendung
Schritt 1: Unmittelbar vor dem Gebrauch die Umverpackung öffnen und die Pipette herausnehmen. Handschuhe anziehen. Die Pipette am Ende oder am festen Teil unterhalb der Kappe in einer aufrechten Position halten, um sie zu öffnen. Die Kappe der Pipette im Uhrzeiger- oder Gegenuhrzeigersinn in einer vollständigen Umdrehung drehen. Die Kappe bleibt auf der Pipette, es ist nicht möglich, diese zu entfernen. Die Pipette ist offen und bereit für den Gebrauch, wenn ein Bruch der Versiegelung gespürt wird.

Schritt 2: Der Hund soll während der Anwendung stehen oder mit dem Rücken nach oben liegen. Die Pipettenspitze vertikal auf die Haut zwischen den Schulterblättern des Hundes halten.
Schritt 3: Die Pipette sanft ausdrücken und den gesamten Inhalt direkt auf die Haut des Hundes auftragen. Das Tierarzneimittel sollte an einer Stelle (wenn das Volumen klein ist) oder gleichmäßig auf mehreren, unterschiedlichen Stellen entlang der Rückenlinie von der Schulter bis zur Schwanzwurzel aufgetragen werden. Nicht mehr als 1 ml Lösung an einer Stelle auftragen, da dies zum Herunterlaufen von Flüssigkeit an der Seite des Tieres führen kann.
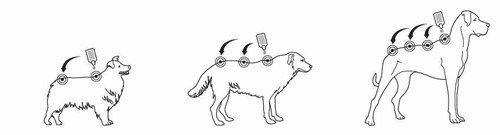
Behandlungsschema:
Bei Infestationen mit Flöhen und Zeckensollten die Notwendigkeit und Häufigkeit von Wiederholungsbehandlungen auf tierärztlicher Beratung beruhen und die lokale epidemiologische Situation und die Lebensweise des Tieres berücksichtigen.
Zur optimalen Kontrolle eines Floh- und Zeckenbefalls sollte das Tierarzneimittel in Abständen von 12 Wochen verabreicht werden.
Für die Behandlung eines Befalls mit Demodex canis Milben sollte eine einmalige Dosis des Tierarzneimittels verabreicht werden. Da die Demodikose eine multifaktorelle Erkrankung ist, ist es empfehlenswert, auch jegliche zugrunde liegende Erkrankung angemessen zu behandeln.
Für die Behandlung eines Befalls mit Sarcoptes-Räude (Sarcoptes scabiei var. canis) sollte eine einmalige Dosis des Tierarzneimittels verabreicht werden. Die Notwendigkeit und Häufigkeit einer Wiederholungsbehandlung sollte in Übereinstimmung mit dem Rat des verschreibenden Tierarztes erfolgen.
Wartezeiten
Nicht zutreffend.
Besondere Lagerungshinweise
Arzneimittel unzugänglich für Kinder aufbewahren.
Für dieses Tierarzneimittel sind bezüglich der Temperatur keine besonderen Lagerungsbedingungen erforderlich.
Die Pipetten sollten in der Originalverpackung aufbewahrt werden, um einen Lösungsmittelverlust oder eine Feuchtigkeitsaufnahme zu vermeiden. Die Beutel sollten erst unmittelbar vor Gebrauch geöffnet werden.
Sie dürfen das Tierarzneimittel nach dem auf dem Karton angegebenen Verfalldatum nach „Exp.“ nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Besondere Vorsichtsmaßnahmen für die Entsorgung
Arzneimittel sollten nicht über das Abwasser oder den Haushaltsabfall entsorgt werden.
Das Tierarzneimittel darf nicht in Gewässer gelangen, da Fluralaner eine Gefahr für Fische und andere Wasserorganismen darstellen kann.
Nutzen Sie Rücknahmesysteme für die Entsorgung nicht verwendeter Tierarzneimittel oder daraus entstandener Abfälle nach den örtlichen Vorschriften und nationalen Sammelsysteme. Diese Maßnahmen dienen dem Umweltschutz.
Fragen Sie Ihren Tierarzt oder Apotheker, wie nicht mehr benötigte Arzneimittel zu entsorgen sind.
Einstufung von Tierarzneimitteln
Tierarzneimittel, das der Verschreibungspflicht unterliegt.
Zulassungsnummern und Packungsgrößen
EU/2/13/158/016-017 112.5 mg
EU/2/13/158/020-021 250 mg
EU/2/13/158/024-025 500 mg
EU/2/13/158/028-029 1 000 mg
EU/2/13/158/030-031 1 400 mg
Jede Schachtel enthält 1 oder 2 Pipetten und ein Paar Handschuhe pro Pipette.
Es werden möglicherweise nicht alle Packungsgrößen in Verkehr gebracht.
Datum der letzten Überarbeitung der Packungsbeilage
16/05/2023
Detaillierte Angaben zu diesem Tierarzneimittel sind in der Produktdatenbank der Europäischen Union verfügbar (https://medicines.health.europa.eu/veterinary).
Weitere Informationen
Das Tierarzneimittel trägt in Bereichen, zu denen behandelte Hunde Zugang haben, zur Kontrolle der Flohpopulation in der Umwelt bei.
Die Wirkung beginnt bei Flöhen (C. felis) innerhalb von 8 Stunden, bei Zecken (I. ricinus) innerhalb von 12
