Equilis® Prequenza
Injektionssuspension für Pferde
Bezeichnung des Tierarzneimittels
Equilis Prequenza Injektionssuspension für Pferde
Zusammensetzung
Eine Dosis (1 ml) enthält:
Wirkstoffe:
Pferdeinfluenzaviren der Stämme:
A/equine-2/South Africa/4/03 50 AE1
A/equine-2/Newmarket/2/93 50 AE
1 Antigene Einheiten
Adjuvans:
ISCOM-Matrix enthält:
gereinigtes Saponin 375 µg
Cholesterin 125 µg
Phosphatidylcholin 62,5 µg
Klare, opalisierende Suspension.
Zieltierart(en)
Pferde.
Anwendungsgebiet(e)
Aktive Immunisierung von Pferden ab einem Lebensalter von 6 Monaten gegen Pferdeinfluenza, um die klinischen Symptome und die Virusausscheidung nach der Infektion zu vermindern.
Beginn der Immunität: 2 Wochen nach der Grundimmunisierung.
Dauer der Immunität: 5 Monate nach der Grundimmunisierung,
1 Jahr nach der 1. Wiederholungsimpfung.
Gegenanzeigen
Keine.
Besondere Warnhinweise
Besondere Warnhinweise:
Nur gesunde Tiere impfen.
Besondere Vorsichtsmaßnahmen für die sichere Anwendung bei den Zieltierarten:
Wegen möglicherweise interferierender maternaler Antikörper sollten Fohlen nicht vor einem Lebensalter von 6 Monaten geimpft werden, insbesondere wenn sie von Stuten abstammen, die in den letzten beiden Monaten der Trächtigkeit nachgeimpft wurden.
Besondere Vorsichtsmaßnahmen für den Anwender:
Bei versehentlicher Selbstinjektion ist unverzüglich ein Arzt zu Rate zu ziehen und die Packungsbeilage oder das Etikett vorzuzeigen.
Trächtigkeit und Laktation:
Kann während der Trächtigkeit angewendet werden.
Wechselwirkung mit anderen Arzneimitteln und sonstige Wechselwirkungen:
Es liegen keine Informationen zur Unschädlichkeit und Wirksamkeit des Impfstoffs bei gleichzeitiger Anwendung eines anderen Tierarzneimittels vor. Ob der Impfstoff vor oder nach Verabreichung eines anderen Tierarzneimittels angewendet werden sollte, muss daher von Fall zu Fall entschieden werden.
Überdosierung:
Nach Verabreichung der doppelten Impfstoffdosis wurden mit Ausnahme von Abgeschlagenheit am Tag der Impfung keine anderen als die unter Abschnitt „Nebenwirkungen“ beschriebenen Nebenwirkungen festgestellt.
Wesentliche Inkompatibilitäten:
Nicht mit anderen Tierarzneimitteln mischen.
Nebenwirkungen
Pferde:
| Selten (1 bis 10 Tiere / 10.000 behandelte Tiere): | Schwellung an der Injektionsstelle1, Schmerzen an der Injektionsstelle2. |
| Sehr selten (< 1 Tier / 10.000 behandelte Tiere, einschließlich Einzelfallberichte): | Fieber3, Lethargie3, Appetitlosigkeit3, Überempfindlichkeitsreaktion4. |
1 Eine diffuse harte oder weiche Schwellung (max. 5 cm Durchmesser), die sich innerhalb von 2 Tagen zurückbildet. Eine lokale Reaktion mit einem Durchmesser von mehr als 5 cm kann in sehr seltenen Fällen auftreten und möglicherweise länger als 2 Tage anhalten.
2 Schmerzen an der Injektionsstelle, die zu vorübergehenden Bewegungseinschränkungen (Steifheit) führen können.
3 Fieber, mitunter begleitet von Lethargie und Appetitlosigkeit, kann an einem Tag und in Ausnahmefällen bis zu drei Tage lang auftreten.
4 Einschließlich Anaphylaxie (in manchen Fällen tödlich). Wenn solch eine Reaktion auftritt, sollte unverzüglich eine angemessene Behandlung eingeleitet werden.
Die Meldung unerwünschter Ereignisse ist wichtig. Es ermöglicht eine kontinuierliche Sicherheitsüberwachung eines Produkts. Wenn Sie Nebenwirkungen feststellen, insbesondere solche, die nicht bereits in dieser Packungsbeilage aufgeführt sind, oder falls Sie vermuten, dass das Tierarzneimittel nicht gewirkt hat, teilen Sie dies bitte zuerst Ihrem Tierarzt mit. Sie können Nebenwirkungen auch an den Zulassungsinhaber unter Verwendung der Kontaktdaten am Ende dieser Packungsbeilage oder über Ihr nationales Meldesystem melden.
Dosierung für jede Tierart, Art und Dauer der Anwendung
Eine Dosis (1 ml). Intramuskuläre Anwendung.
Impfschema:
Grundimmunisierung
Nach folgendem Schema je eine Dosis (1 ml) intramuskulär injizieren:
– Grundimmunisierung: die 1. Injektion ab einem Lebensalter von 6 Monaten, die 2. Injektion 4 Wochen später
Wiederholungsimpfung
Es wird empfohlen, eine einfache Auffrischungsdosis nur an Pferde zu verabreichen, die bereits eine Grundimmunisierung mit Impfstoffen erhalten haben, die dieselben Typen equiner Influenzaviren enthalten, wie dieser Impfstoff. Eine Grundimmunisierung muss möglicherweise bei Pferden, die nicht entsprechend grundimmunisiert wurden, in Betracht gezogen werden.
Die erste Wiederholungsimpfung (3. Dosis) wird 5 Monate nach der Grundimmunisierung verabreicht. Die Dauer der Immunität gegen Pferdeinfluenza nach dieser Wiederholungsimpfung beträgt mindestens 12 Monate.
Die 2. Wiederholungsimpfung wird 12 Monate nach der 1. Wiederholungsimpfung verabreicht.
Die im 12-Monats-Intervall wechselnde Anwendung eines geeigneten Impfstoffs gegen Pferdeinfluenza mit den Stämmen A/equine-2/South Africa/4/03 und A/equine-2/Newmarket/2/93 wird empfohlen, um den Immunstatus für die Influenza-Komponente aufrecht zu erhalten (siehe Schema).
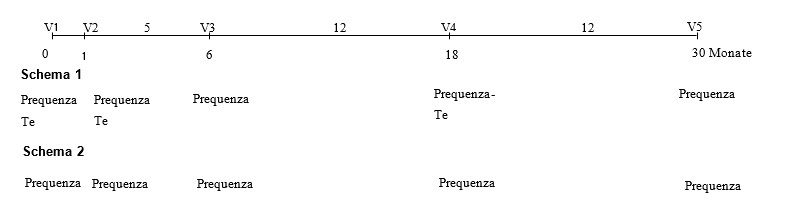
Im Falle eines erhöhten Infektionsrisikos oder einer unzureichenden Kolostrumaufnahme kann eine zusätzliche erste Injektion im Alter von 4 Monaten verabreicht werden, gefolgt von einem vollständigen Impfprogramm (Grundimmunisierung im Alter von 6 Monaten und 4 Wochen später).
Hinweise für die richtige Anwendung
Den Impfstoff vor Gebrauch auf Raumtemperatur bringen.
Wartezeiten
Null Tage.
Besondere Lagerungshinweise
Arzneimittel unzugänglich für Kinder aufbewahren.
Im Kühlschrank lagern (2 °C – 8 °C).
Nicht einfrieren.
Vor Licht schützen.
Sie dürfen dieses Tierarzneimittel nach dem auf dem Etikett angegebenen Verfalldatum nach „Exp.“ nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Besondere Vorsichtsmaßnahmen für die Entsorgung
Arzneimittel sollten nicht über das Abwasser oder den Haushaltsabfall entsorgt werden.
Nutzen Sie Rücknahmesysteme für die Entsorgung nicht verwendeter Tierarzneimittel oder daraus entstandener Abfälle nach den örtlichen Vorschriften und die für das betreffende Tierarzneimittel geltenden nationalen Sammelsysteme. Diese Maßnahmen dienen dem Umweltschutz.
Fragen Sie Ihren Tierarzt oder Apotheker, wie nicht mehr benötigte Arzneimittel zu entsorgen sind.
Einstufung von Tierarzneimitteln
Tierarzneimittel, das der Verschreibungspflicht unterliegt.
Zulassungsnummern und Packungsgrößen
EU/2/05/056/001-004
Packungsgrößen:
Faltkarton mit 10 Durchstechflaschen mit je 1 ml (1 Dosis).
Faltkarton mit 1, 5 oder 10 Fertigspritzen mit je 1 ml (1 Dosis) und Kanülen.
Es werden möglicherweise nicht alle Packungsgrößen in Verkehr gebracht.
Datum der letzten Überarbeitung der Packungsbeilage
Detaillierte Angaben zu diesem Tierarzneimittel sind in der Produktdatenbank der Europäischen Union verfügbar (https://medicines.health.europa.eu/veterinary).
